
Resumen: Estoy seguro que muchos de nosotros pensamos que el átomo se asemeja al sistema planetario, con un núcleo y electrones girando alrededor de él. Bueno, en la escuela nos lo enseñaron así y seguramente nunca hemos tenido la oportunidad de cuestionarlo. En realidad este modelo fue solo uno de los muchos modelos atómicos propuestos a lo largo de la historia. El modelo más actual te lo explicaremos en este artículo, pues es en el que nos basamos para desarrollar nuevas tecnologías.
Ya ha pasado algún tiempo desde que terminó mi participación en la elaboración de un libro de ciencias para niños, una experiencia estupenda que repetiré sin duda y a título personal. Hoy, revisando una revista de ciencias, encontré un artículo y recordé casi instantáneamente lo difícil que fue transmitir a los niños aquello que alguna vez estudié en los cursos de mecánica cuántica. Ese artículo trataba sobre las diferentes formas de representar el átomo, ya sea por los físicos, químicos o biólogos. En este post trataré de describir al átomo, de tal forma que cuando se lo expliquemos a los niños, puedan entenderlo y no perdamos el rigurosidad.
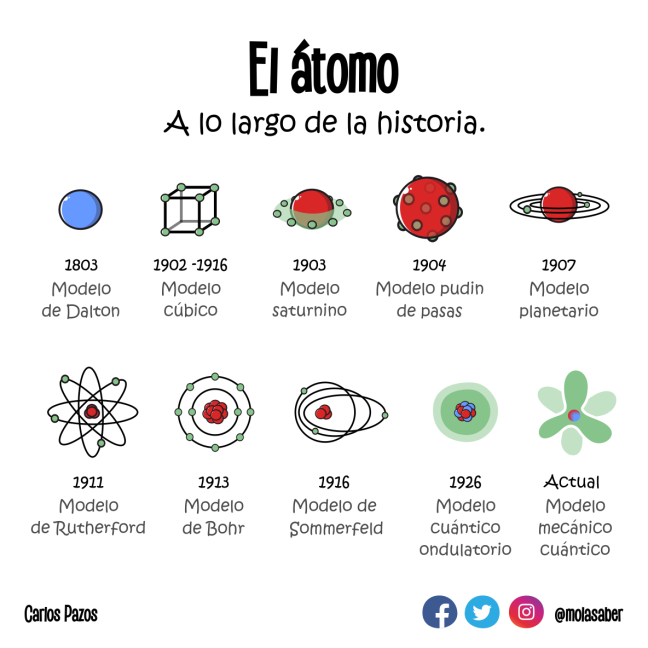
Si escribimos la palabra átomo en un buscador de internet, nos daremos cuenta que el dibujo más común y corriente para describir un átomo es el que se muestra en la parte superior del artículo (o modelo de Rutherford de 1911 en la Fig.1). Este dibujo representa el núcleo atómico y los electrones “orbitando” al fiel estilo de los planetas alrededor del Sol. Esta forma de representar al átomo como un sistema planetario es conocido como el modelo de Rutherford y fue formulado en 1911. Si este modelo fue formulado hace tanto tiempo ¿por qué tendríamos que explicárselo a los niños como si fuera el actual? En la Fig. 1 podemos observar la evolución de los modelos atómicos, desde el modelo del átomo indivisible formulado por los griegos, pasando por el “pastel de pasas” propuesto por Thomson, hasta llegar a la cuantización de los niveles energéticos, conocidas como órbitas de los electrones, propuesta por Bohr y la “nube electrónica” propuesta por Schrodinger en 1924. Vayamos por partes.
Estructura
Es importante explicarles a los niños sobre cómo está constituido un átomo, y explicarles también que la ciencia es dinámica y avanza cada día, por lo que esta podría proponernos un nuevo modelo en algún momento no muy lejano, no lo sabemos. Empecemos indicando que hay dos regiones bien marcadas en un átomo, el núcleo y sus alrededores. El núcleo está constituido por neutrones y protones, ubicados en el centro del átomo. Mientras que en los alrededores, en una región llamada “nube electrónica” se encuentran los electrones, los cuales son mucho más livianos que los protones y neutrones. Esta región vendría a ser, en los modelos propuestos por Rutherford y Thomson y Bohr, las órbitas. El núcleo se puede dividir, en contra de lo que pensaban los griegos, liberando mucha energía. Esta reacción se llama fisión nuclear, utilizada en las bombas atómicas. También hay que explicarle a los niños que existen partículas mucho más pequeñas que los electrones, llamadas partículas sub-atómicas como los quarks, los neutrinos o el recientemente descubierto Bosón de Gibbs. Por lo tanto, si existe algo más pequeño que el átomo (lo siento amigos griegos).

Sigamos adelante. Lo que nos interesa es explicar es que los electrones no se encuentran girando en órbitas circulares, que aquello es una representación. Los electrones se encuentran en regiones con formas características. Estas hermosas regiones, las cuales son mostradas en la Fig. 2, son descritas por funciones (soluciones de ecuaciones), y que un electrón se encuentre por allí (o no) dependerá de su energía. Algo muy importante es que no es posible conocer su posición exacta y su velocidad, siempre tendremos un margen de indeterminación llamado el principio de incertidumbre o de indeterminación. el simple hecho de “mirar” al electrón genera que perturbemos el sistema y este ya no seencuentre donde el que hemos visto. Lo único que podemos afirmar es que existe la probabilidad de encontrar al electrón en alguna región. La mecánica cuántica describe a los electrones como ondas con cierta probabilidad de encontrarse por todos lados. Esta es la razón por la cual el último modelo atómico, propuesto en 1930 y que observamos en la Fig. 1 (al final) muestra una nube electrónica en lugar de los electrones girando como los modelos anteriores. Pero como mencionamos previamente, la probabilidad de encontrar electrones en ciertas regiones depende de su energía. Por ello, las diferentes formas de orbitales acogen diferentes electrones.
En la Fig. 2 se muestran estas regiones, usando por simplicidad el átomo de hidrógeno pues tiene un solo electrón. El color morado indica menor probabilidad de encontrar al electrón y el color amarillo, una mayor probabilidad de encontrarlo. Si el electrón de este átomo de hidrógeno tuviera diferentes energías se encontraría en diferentes regiones como las descritas. En el caso de átomos con más electrones (todos los demás elementos distintos del hidrógeno) las regiones en las cuales se encuentran tienen otras formas. Los números entre paréntesis en la Fig. 2 representan los números cuánticos (nivel de energía (n), momento angular (l), momento magnético (m) de los electrones). Estos son característicos de cada electrón y definen, mediante una expresión matemática, la región en la que se encontrarán. El último número cuántico, el espín, no lo tomaremos en cuenta en este artículo pero si mencionaremos que es el responsable de la espintrónica, la base de nuevas tecnologías en el almacenamiento y lectura de datos en las computadoras.

Sería genial que pudiéramos ver a los átomos y sus nubes electrónicas con nuestros ojos, pero esto no es posible. Los objetos que podemos observar a simple vista o con un microscopio óptico como el de la Fig. 3 deben tener un tamaño del orden de la longitud de onda de la luz visible, tan pequeño como 0.0000001 metros (este número con tantos ceros, se escribe mejor así: 10-7 metros o 100nm, 100 nanómetros). Es decir, la luz visible (diferentes colores) debe poder ser reflejada por estos objetos. Los átomos son mucho más pequeños, por lo tanto la luz no puede “detectarlos”, digamos que son “invisibles” para la luz. Gracias a la tecnología actual existen instrumentos que nos permiten observarlos. Estos son llamados microscopios electrónicos (Fig. 4) pues no utilizan la luz visible sino, por el contrario, utilizan un haz (un rayo) de electrones. La longitud de onda asociada al haz de electrones es más pequeña que la luz visible, posibilitando de esta forma el detectar objetos mucho más pequeños. Últimamente, cuando leemos una revista científica, encontramos diferentes formas de representar a los átomos, dependiendo de las propiedades que se quieran resaltar. Los científicos que estudian las superficies de los materiales para las nuevas tecnologías suelen mostrar imágenes de los microscopios electrónicos, como la de la Fig.5, donde se puede observar montículos o esferas ordenadas.
Como hemos visto en este pequeño artículo, si bien es cierto, existen varias formas de representar a los átomos (por simplicidad), todas éstas deben incluir una explciacion sobre el marco actual dado por la mecánica cuántica, con conceptos de probabilidades, de dualidad ondas-partícula. Los fundamentos de la mecánica cuántica pueden ser explicados a los jóvenes en diferentes niveles, mostrando y señalando siempre ejemplos de como la tecnología utiliza mucho de estos conceptos para hacernos la vida mucho más fácil, con dispositivos como las pantallas táctiles de los celulares, el blue ray, la memoria de los USB, cámaras HD muy pequeñas, etc.
|
|
|
 Sobre el Autor:
Sobre el Autor:
Nahuel Monteblanco PhD. en nanofísica de la Universidad de Grenoble-Alpes en Francia, Egresado de la UNI. Trabaja en la fabricación y desarrollo de dispositivos espintrónicos basados en válvulas de spin y junciones túnel magnéticas, incluidos sensores de campo magnético. Fundador de la plataforma de apoyo a la investigación científica Científicos.pe. Actualmente es investigador en la compañia Spin-Ion Technologies en Paris.
Pero ojo, tengamos cuidado pues siempre existe la probabilidad de caer en una orbita circular y explicar las cosas como en el siguiente video:









Gracias por la explicación, sin perder la rigurosidad.
Hacemos lo posible por no perderla 🙂